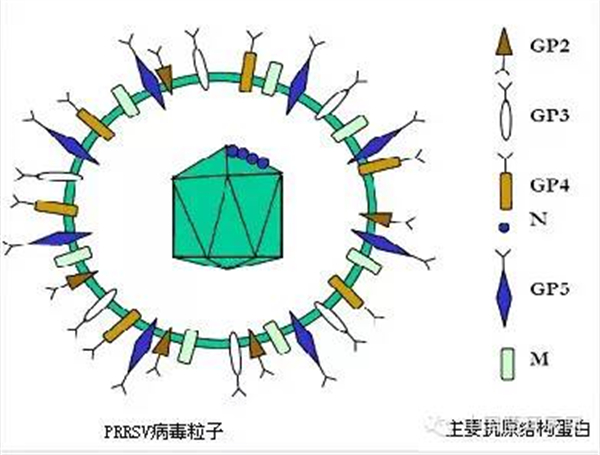
【蓝耳病病毒】猪蓝耳病毒(PRRSV)
来源:网络 2021-12-09 16:45:46| 查看:
次
猪蓝耳病俗称猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome, PRRS)技术 3、细胞因子种猪 种猪 种猪 种猪 种猪 种猪 猪病
【版权声明】 养猪网旗下所有平台转载的文章均已注明来源、养猪网原创文章其他平台转载需注明来源且保持图文完整性、养猪网特别说明的文章未经允许不可转载,感谢您的支持与配合;我们所有刊登的文章仅供养猪人参考学习,不构成投资意见。若有不妥,请及时联系我们,可添加官方微信号“zgyangzhuwang”!